Sistem Koloid atau biasa disebut koloid adalah suatu campuran homogen yang terdiri dari dua atau lebih zat yang berukuran 1-100 nm. Posisi koloid berada di tengah bila dibandingkan dengan larutan dan suspensi. Hal tersebut dilihat dari ukuran partikel penyusunnya, larutan merupakah campuran homogen yang tidak bisa dibedakan antara pelarut dan zat terlarutnya. Sedangkan suspensi adalah campuran zat terlarut yang ukurannya mudah dilihat dengan mata telanjang. Ukuran zat terlarut (fase terdispersi) koloid hanya dapat dibedakan bila dilihat dengan mikroskop ultra.
Sehingga bila ditentukan berdasarkan ukuran partikelnya koloid merupakan sistem dispersi yang ukuran partikelnya lebih besar dari larutan namun lebih kecil bila dibandingkan dengan suspensi. Beberapa koloid bila didiamkan dalam waktu relatif lama dapat terpisah walaupun tidak semuanya. Contohnya adalah santan dan susu, jika dibiarkan seharian misalnya komponennya akan terlihat tidak tercampur. Agar lebih mudah dipelajari berikut adalah rangkuman materi koloid untuk kamu.
1. Jenis Koloid
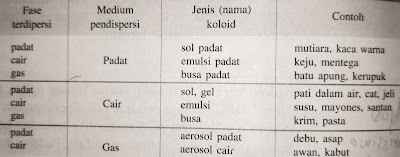
Jenis-jenis koloid ditentukan berdasarkan zat terdispersi dan medium pendispersinya. Saat suatu zat dicampurkan dengan zat yang lain maka terjadi penyebaran suatu zat ke dalam zat yang lain. Sistem koloid dapat terjadi jika zat terdispersi pada fase cair, padat atau gas tercampur dalam medium pendispersi pada fase padat, cair atau gas. Zat terdispersi tidak akan menghasilkan jika berada pada medium pendispersi berupa gas juga. Agar lebih mudah memahami jenis koloid, perhatikan tabel berikut ini.
Aku akan berikan beberapa penjabaran cara membaca tabel tersebut. Mutiara adalah jenis koloid sol padat karena berasal dari campuran terdispersi padat dan medium pendispersi padat juga. Untuk kabut adalah sistem koloid dari zat terdispersi cair dalam medium pendispersi gas yang disebut aerosol cair. Penyusun sistem koloid asap adalah fase terdispesinya padat dalam medium pendispersi gas, sehingga jenis koloidnya adalah aerosol padat. Beberapa sistem koloid berikut termasuk golongan emulsi yaitu susu, santan dan mayones.
2. Sifat-sifat Koloid dan Penerapannya
Sistem koloid memiliki ciri khas yang dapat membedakannya dengan sistem dispersi lain. Beberapa sifat koloid tersebut adalah:
a. Efek Tyndall
Pengertian dari Efek Tyndall adalah peristiwa penghamburan cahaya oleh partikel koloid. Karena ukuran partikel koloid cukup besar maka saat berkas sinar melewatinya akan dihamburkan, sedangkan bila sinar melewati larutan tidak dihamburkan karena ukuran partikelnya sangat kecil. Contoh efek Tyndall dalam kehidupan sehari-hari adalah
- Langit berwarna jingga saat sore hari dan biru saat siang hari
- Sorot lampu kendaraan atau senter di udara berkabut.
- Sinar matahari yang melewati celah dedaunan di pagi hari yang berkabut.
b. Gerak Brown
Gerakan acak atau lurus partikel koloid dalam medium pendispersi disebut gerak Brown. Dispersi koloid ini hanya dapat diamati di bawah mikroskop ultra yang memiliki pembesaran yang tinggi. Gerak Brown ini terjadi akibat terjadinya tumbukan antara partikel pendispersi dengan partikel terdispersi yang mengakibatkan partikel terdispersi terlontar. Kejaian berulang tersebut berlangsung karena ukuran partikel terdispersi lebih besar dibanding pendispersi. Adanya gerak Brown ini menyebabkan partikel koloid menjadi stabil karena gerakan yang terus menerus melawan gaya gravitasi.
c. Muatan Listrik pada Partikel Koloid
Partikel koloid memiliki muatan listrik yang disebabkan oleh hal-hal berikut ini:
- Elektroforesis. Pengertiannya adalah peristiwa bergeraknya partikel kolid dalam medan magnet. Sifat elektroforesis ini dimanfaatkan pada proses penyaringan debu pabrik dan proses pemisahan potongan gen pada proses bioteknologi.
- Adsorpsi. Pengertian sifat adsorpsi ini adalah proses penyerapan muatan oleh permukaan zat lain (koloid). Kemampuan partikel koloid menarik (ditempeli) partikel kecil lain ini yang menyebabkan sifat adsorpsi tersebut. Contoh proses yang memanfaatkan sifat koloid adsorpsi ini adalah
a) Pemberian norit saat sakit perut yang disebabkan oleh bakteri patogen.
b) Penjernihan air menggunakan tawas
c) Proses pewarnaan menggunakan serat wol
d) Penjernihan air tebu saat proses pembuatan gula pasir
- Koagulasi. Disebut juga penggumpalan, koagulasi adalah peristiwa mengendapnya partikel koloid yang menyebabkan fase terdispersi terpisah dengan medium pendispersi. Contoh penerapan dari sifat koagulasi misalnya
a) Pengolahan lateks menjadi karet
b) Pembetukan delta di muara
c) Penggumpalan debu atau asap yang ada di pabrik
d) Penetralan partikel albuminoid yang ada dalam darah dengan ion Fe3+ atau ion Al3+
b) Pembetukan delta di muara
c) Penggumpalan debu atau asap yang ada di pabrik
d) Penetralan partikel albuminoid yang ada dalam darah dengan ion Fe3+ atau ion Al3+
- Koloid Pelindung. Makna dari koloid pelindung adalah koloid yang ditambahkan untuk melindungi koloid lain menghindari terjadinya koagulasi. Sifat koloid pelindung ini dapat dimanfaatkan dalam kehidupan sehari-hati pada proses
a) Penambahan gelatin pada es krim agar tetap kenyal
b) Penambahan kasein dalam susu
c) Penambahan gum arab pada pembuatan semir
d) Penambahan lesitin pada margarin
e) Penambahan minyak silikon dalam cat
- Dialisis. Cara untuk mengurangi ion pengganggu yang terdapat dalam koloid menggunakan selaput semipermeabel disebut dialisis. Membran semipermeabel ini dapat ditembus oleh ini namun tidak dapat dilalui partikel koloid. Contoh penerapan sifat dialisis ini adalah
a) Proses cuci darah
b) Pemisahan ion sianida dalam tepung tapioka
4. Koloid Liofil dan Koloid Liofob
Bila dibedakan berdasarkan interaksi partikel terdispersi dengan medium pendispersinya, sistem koloid dapat dibedakan menjadi dua yaitu koloid liofil dan liofob.
Koloid liofil merupakan koloid yang fase terdispersinya cenderung menarik medium pendispersinya. Hal tersebut disebabkan adanya gaya tarik yang kuat terjadi antara partikel terdispersi dengan medium pendispersinya. Sedangkan koloid liofob adalah sistem koloid yang fase terdispersinya tidak suka menarik medium pendispersinya. Jika medium pendispersinya adalah air maka koloid liofil disebut koloid hidrofil dan koloid liofob disebut koloid hidrofob.
Contoh pemanfaatan sifat hidrofob dan hidrofil adalah saat proses mencuci pakaian menggunakan detergen. Proses ini diperlukan saat noda yang ada pada kain tidak mudah larut dalam air misalnya kotorannya berupa lemak. Detergen inilah yang memiliki ujung lifil dan liofob. Dimana ujung liofil-nya larut dalam air ujung liofob-nya menempel pada noda lemak. Gaya tarik menarik yang terjadi menyebabkan tegangan permukaan air menurun dan air dapat meresap pada kain yang kemudian lemak dapat lepas.
5. Pembuatan Koloid
Ditinjau dari pengubahan ukuran partikel zat terdispersi maka pembuatan koloid dapat dibedakan menjadi dua macam yaitu cara dispersi dan cara kondensasi.
1. Cara Kondensasi yaitu pembuatan koloid yang memperbesar ukuran partikel dengan mengubah partikel larutan berupa ion atau molekul menjadi partikel koloid. Contohnya adalah
a) Pembuatan sol AgCl dengan mencampur larutan AgNO3 dengan larutan HCl atau NaCl.
b) Pembuatan sol Fe(OH)3 dengan meneteskan FeCl3 ke dalam air mendidih.
c) Pembuaan sol raksa dengan mengembunkan uap raksa melalui air dingin.
2. Cara Dispersi dilakukan dengan memperkecil ukuran partikel yaitu pembuatan koloid dari suspensi. Contoh pembuatan koloid dengan cara dispersi adalah
a) Pembuatan sol belerang dengan mengalirkan gas H2S dalam endapan CdS atau NiS.
b) Penambahan larutan AlCl3 dalam endapan Al(OH)3 untuk membuat sol Al(OH)3.
***
Itulah rangkuman materi Koloid untuk kamu yang sedang belajar kimia. Materi ini ada di kelas XI semeter genap dan merupakan materi penutup kelas 11. Semoga bermanfaat dan kamu bisa menyelesaikan latihan soal tentang koloid.

0 Response to "Rangkuman Materi Mendeskripsikan Sistem dan Sifat Koloid Serta Penerapannya"
Posting Komentar