Tahun ajaran baru 2020/2021 kita masih harus prihatin dalam melaksanakan pembelajaran. Belum diputuskan kapan sekolah diizinkan belajar tatap muka secara langsung seperti biasanya. Walaupun begitu kita masih harus melaksanakan belajar secara daring atau dalam jaringan internet, yang lebih akrab kita sebut belajar online. Untuk materi kimia kelas XII semester satu ini diawali dengan materi Sifat-Sifat Koligatif Larutan.
Sebelum memahami sifat koligatif unsur, kamu harus ingat tentang pengertian larutan. Larutan adalah campuran homogen yang terdiri dari pelarut dan zat terlarut. Jika kamu membuat larutan garam, maka yang bertindak sebagai pelarut adalah air dan garam adalah zat terlarutnya.
Lalu apa itu sifat koligatif Larutan?
Agar mudah memahami pengertiannya, perhatikan ilustrasi berikut. Ada 4 gambar wadah (a, b, c, dan d) masing-masing berikut berisi 1 Kg air.
Untuk wadah A hanya berisi air 1 Kg tanpa zat terlarut dengan titik beku 0⁰C. Wadah B berisi 1 Kg air dengan ditambah 0,1 mol urea ternyata memiliki titik beku -0,18⁰C. Wadah C berisi 1 Kg air juga dengan penambahan urea sebanyak 0,2 mol ternyata titik bekunya adalah -0,36⁰C. Sedangkan wadah D yang sama-sama berisi 1 Kg air diberi penambahan 0,1 mol glukosa titik bekunya -0,18⁰C.
Dari ilustrasi gambar di atas bisa kita buat perbandingan yaitu:
1. Wadah B dan C
Antara wadah B dan C yang sama-sama berisi air 1 Kg namun berbeda pada penambahan urea yaitu 0,1 mol dan 0,2 mol. Ternyata titik beku lebih kecil pada wadah C dengan zat terlarut lebih banyak (titik didik (Tf) berbeda).
2. Wadah B dan D
Wadah B dan D yang juga berisi 1 Kg air dan jumlah mol zat terlarutnya sama yaitu sebanyak 0,1 mol. Namun perbedaannya pada jenis zat terlarutnya, wadah B berisi urea sedangkan wadah D ditambah glukosa. Titik beku (Tf) kedua larutan tersebut ternyata sama yaitu -0,18⁰C.
Dari dua perbandingan tersebut maka kita bisa menyimpulkan bahwa sifat koligatif adalah sifat larutan yang tidak bergantung pada jenis zat terlarut, melainkan bergantung pada konsentrasi partikel yang terlarut di dalamnya.
Pada pembahasan di atas masih difokuskan pada sifat koligatif larutan nonelektrolit dahulu. Dimana larutan nonelektrolit adalah elektron yang tidak dapat membentuk ion-ion bila dilarutkan dalam pelarut. Sedangkan larutan elektrolit adalah larutan yang membentuk ion pembentuknya jika dilarutkan dalam pelarut. Sehingga jumlah partikel larutan nonelektrolit dan elektrolit dalam larutan akan berbeda walaupun jumlah mol sama.
Pada pembahasan di atas masih difokuskan pada sifat koligatif larutan nonelektrolit dahulu. Dimana larutan nonelektrolit adalah elektron yang tidak dapat membentuk ion-ion bila dilarutkan dalam pelarut. Sedangkan larutan elektrolit adalah larutan yang membentuk ion pembentuknya jika dilarutkan dalam pelarut. Sehingga jumlah partikel larutan nonelektrolit dan elektrolit dalam larutan akan berbeda walaupun jumlah mol sama.
Untuk sifat koligatif yang akan dibahas adalah penurunan tekanan uap larutan, kenaikan titik didih, penurunan titik beku dan tekanan osmotik. Sebelumnya kita harus memahami terlebih dahulu perhitungan konsentrasi larutan, yaitu menghitung kemolaran, kemolalan, dan fraksi mol.
Kemolaran/Molaritas (M)
Pengertian kemolaran atau molaritas adalah menyatakan jumlah mol zat terlarut yang ada dalam satu liter larutan. Rumusnya adalah
M : kemolaran atau molaritas, satuannya mol/liter
n : jumlah mol zat terlarut, satuannya mol
V : volume larutan, satuannya liter
Contoh soal:
6 gram urea (mr=60) dilarutkan dalam 1 liter air. Berapakah molaritas larutan tersebut?
Cara menghitungnya adalah dengan menentukan (n) dan (V) larutan tersebut, yaitu jumlah mol (n) dapat ditentukan dengan membagi antara massa zat terlarut (urea) dengan mr, sehingga
Kemolalan/ Molalitas (m)
Kemolalan atau molalitas (m) adalah jumlah mol (n) zat terlarut yang berada dalam satu kilogram (Kg) atau 1000 gram pelarut. Dengan rumus
m : kemolalan/molalitas, satuannya mol /kg
n : jumlah mol zat terlarut, satuannya mol
p : massa pelarut dalam Kg, satuannya Kg
Contoh soal:
6 gram urea (mr=60) dilarutkan dalam 1000 gram air. Berapakah molalitas larutan tersebut?
Cara menghitungnya adalah dengan menentukan (n) dan (p) larutan tersebut diubah satuannya menjadi Kg, yaitu dari 1000 gram menjadi 1 Kg. Maka,
Jumlah mol (n) dapat ditentukan dengan membagi antara massa zat terlarut (urea) dengan mr, sehingga
Jumlah mol (n) dapat ditentukan dengan membagi antara massa zat terlarut (urea) dengan mr, sehingga
Fraksi mol (X)
Fraksi mol (X) adalah sebuah perbandingan jumlah mol zat terlarut atau pelarut terhadap jumlah mol larutan. Karena dalam larutan terdapat dua komponen yaitu pelarut dan zat terlarut. Maka dimisalkan zat terlarut adal A sedangkan pelarut adalah B. Maka untuk mencari fraksi mol masing-masing fraksi mol-nya yaitu
Sehingga jumlah fraksi mol pelarut dan zat pelarut adalah 1.
XA + XB = 1
Contoh soal
Bila dalam suatu larutan urea yang terbentuk dari 4,44 mol air dan 0,33 mol urea. Maka berapakah fraksi mol urea tersebut?
Cara menghitungnya adalah dengan rumus

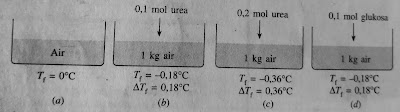






0 Response to "Menghitung Konsentrasi Larutan dan Pengertian Sifat-Sifat Koligatif Larutan "
Posting Komentar